(来源: Clinical and Translational Medicine )
此前,该团队于 2019 年在 Cancer Research 上发表了其发现的 第一个全癌标志物 HIST1H4F。

(来源:Cancer Research)
“但其实,全世界都在说每种肿瘤基本上都不一样,都在做精准医学(个性化医学)的时候,我们说发现了全癌标志物这样一个所有肿瘤的共同特征,绝大部分人是很难理解和接受的。”
于文强也提到,“不过现在很多人在做泛癌标志物,说明大家还是希望能够有一种方法来诊断多种癌症,只不过我们具体采用的策略不同 —— 泛癌标志物筛查本质上是用多种标志物诊断多种肿瘤,就是把多种单一癌症标志物放到一个大 panel 里,通过这个 panel内所有基因的检测去判断是否存在癌症,是 ‘多对多’的关系。而全癌标志物是在目前研究的所有肿瘤中都存在的甲基化位点,全癌标志物检测就是用这样的一个或两个标志物诊断多种癌症,是‘一对多’的关系。全癌标志物和泛癌标志物的目标都是一样的。”
另外,于文强表示,“全癌标志物和泛癌标志物的检测方法也是不同的,目前泛癌标志物只能通过二代测序检测,相比之下,只有一个或两个位点的全癌标志物可以用 qPCR 等简单的方法检测。”
一个标志物,“识别” 17 种癌症
随着 DNA 甲基化的研究发展,DNA 甲基化检测已可用于多种肿瘤的早期筛查、辅助诊断、疗效判定以及预后监测等,通常不同的肿瘤可分别通过不同的标志物检测出来。
目前,DNA 甲基化检测主要通过焦磷酸测序或高通量测序(NGS)进行,若想获得人体全基因组范围内单碱基分辨率的所有 DNA 甲基化情况,则通常需要借助全基因组 DNA 甲基化测序技术(Whole Genome Bisulfite Sequencing,WGBS)实现,只是这些方法的成本高昂,很难为寻常百姓所用。
正如业内流传的那般,于文强也提到 “做 DNA 甲基化检测是有钱人的游戏”,他进一步说,这一方面是因为需要检测的位点很多,另一方面也是由测序的方式造成的。“当时(2010 年左右)二代测序的比对率不到 30%,造成数据浪费的同时,也是对人力和财力的极大消耗。”
面对这一现状,于文强团队自主开发了新型测序技术(GPS),并通过这项技术发现了全癌标志物,目前已公开报告的有前文提到的 HIST1H4F 和 PCDHGB7。
关于全癌标志物 HIST1H4F 的报告论文中显示,他们首先在肺癌中发现多个组蛋白基因异常的高甲基化状态。进一步验证中,他们在分析肿瘤基因组图谱 (TCGA) 数据库 17 种肿瘤(肺癌、肝癌、乳腺癌、食管癌、宫颈癌等)的 7000 多例样本分析中发现,某些组蛋白基因在多种癌症中均存在甲基化异常现象,尤其是 HIST1H4F 基因。
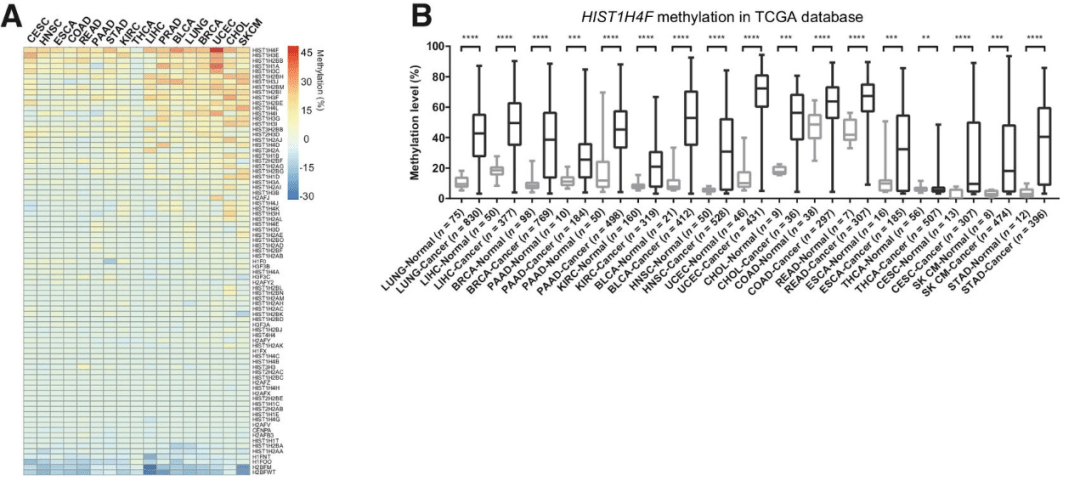
图|17 种肿瘤中 85 种组蛋白基因的甲基化状态 (A)、HIST1H4F 在 17 种肿瘤中的甲基化状态(B)(来源:论文)
为进一步验证这一现象,于文强团队在 8 种肿瘤临床样本中进行检测,他们发现,在这 8 种肿瘤样本中,HIST1H4F 均存在高甲基化现象。由此,于文强提出, HIST1H4F 是潜在的肿瘤共有标志物,"全癌标志物" 也是从这是开始提出的。“当用一个位点就能检测出癌症,成本自然很低,甚至比现在的新冠检测(2 个位点)更低。”
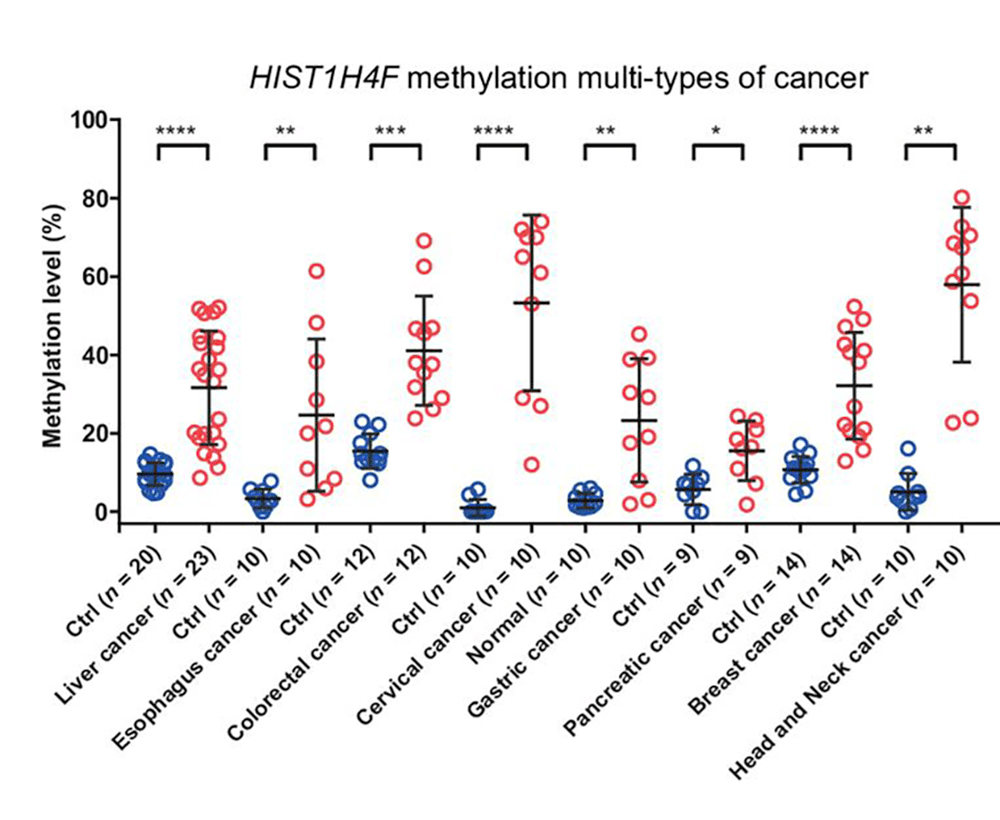
图|HIST1H4F 基因在 8 种肿瘤临床样本中的甲基化状态(来源:论文)
先有 GPS,再有全癌标志物
这里的 GPS 是 Guide Positioning Sequencing 的缩写,含义也很直白,即 “导航定位测序”,正是前文提到的于文强团队历时 8 年开发的全基因组 DNA 甲基化检测新方法。如 Global Positioning System 一般,GPS(Guide Positioning Sequencing)也具有定位功能,不同之处在于,GPS 用于 DNA 甲基化的定位。全癌标志物的发现,也正是在 GPS 的基础上实现的。
开发 GPS 的故事,要从于文强对线粒体 DNA 甲基化的兴趣说起。
2009 年底,在瑞典乌普萨拉大学 Rolf Ohlsson 教授实验室和约翰霍普金斯大学医学院从事近 10 年 DNA 甲基化研究工作后,于文强回到中国,并选择一条与出国前不尽相同的医学道路 —— 从临床医生到专注科研。
归国后,于文强来到复旦大学并牵头表观遗传学领域中国第三个 973 项目,进行 DNA 甲基化研究。“有一天,我在寻找线粒体 DNA 的甲基化信息,但竟然没有任何信息可用。当时我们已经进入二代测序时代,如果连仅有 16kb 的线粒体 DNA 都没有甲基化信息,那不能说线粒体 DNA 甲基化不重要,而是说明全基因组 DNA 甲基化检测一定存在什么问题 —— 序列比对率低、比对准确性差。” 这也正是 DNA 甲基化检测普及的障碍:价格高,但靠谱度低。
“出现这两大问题是由于测序策略上出现了偏差,” 于文强说,“其实现在的 DNA 甲基化检测用的是一个非常绕的方法,先用 Bisulfite 处理 DNA 序列,把基因组中未发生甲基化的 C 碱基转换成 T,以与原本具有甲基化修饰的 C 碱基进行区分,但是这样一来,原本人体基因组序列中的 4 个碱基就变成了 3 个,导致很多序列即使测到了也无法实现准确比对。”
面对这一问题,他们决定尝试优化双端测序的方案,即一端是在 Bisulfite 处理后仍保持基因组原序列,另一端则是转化后的表观检测序列。
具体实现上,“我们想到 T4 DNA 聚合酶,在反应体系中没有 dNTP 的情况下,可以发挥 3'-5' 外切酶的活性,当反应体系中存在 dNTP 时可以发挥 5'-3' 聚合酶的活性,不过在反应体系中,我们将 dNTP 中的胞嘧啶换成甲基化的胞嘧啶就可以了。这样一来,所有的 DNA 片段 3' 端在亚硫酸盐处理后还保持基因组序列,可用来定位;5' 端可以用来计算甲基化。"
这种方法就是前文提到的新型测序技术 GPS(Guide Positioning Sequencing),于文强表示,目前该技术已经获得国内和国际专利。
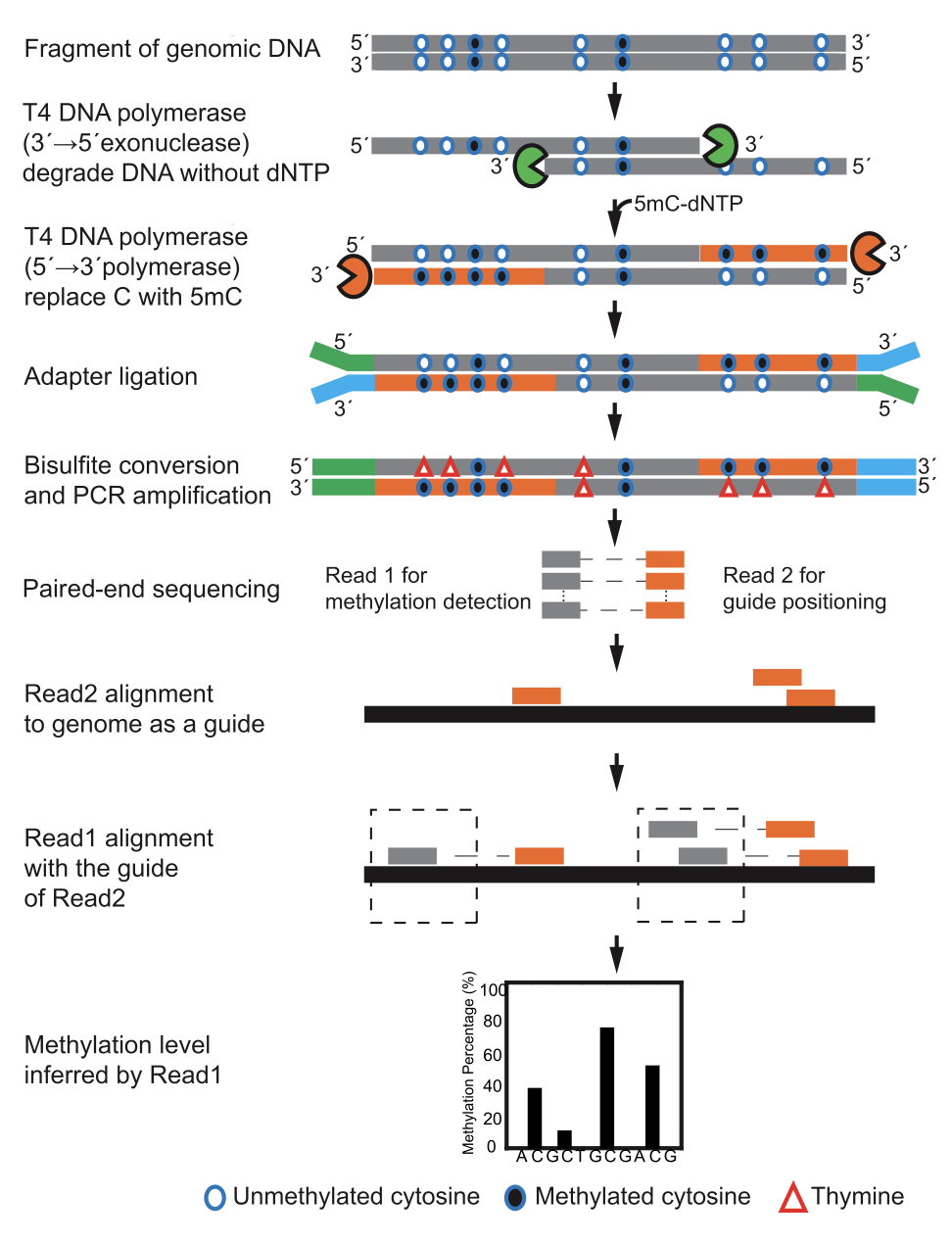
图 | GPS(Guide Positioning Sequencing)工作原理(来源:相关论文)
从 “别人根本不相信”,到已完成近 2 万例样本筛查
于文强与表观遗传学于 2001 年结缘,而他对医学知识的系统学习早在 1983 年开始。
从 1983 年踏入第四军医大学、在四医大西京医院 12 年临床医生到如今走在医学科研最前沿,从 2001 年进入表观遗传学领域到发现或可适用于全部癌症的 DNA 甲基化标志物,于文强以 “我的经历背景比较简单” 这样平淡的一句话概括他深耕 30 多年的医学之路。
但每每,说到全癌标志物的时候,他便滔滔不绝。“我认为,全癌标志物的发现意义非常非常重大,这可能会改变我们对肿瘤的很多理解。”
只是,就如前文所说,目前全癌标志物的接受度并不是很高。于文强坦言,“很多人根本不相信。没关系,如果相信我们可以一起做研究,如果不相信,那也不要紧,时间会证明一切。”
于文强表示,“我觉得做研究、做实验有一个事情非常重要,就是思维永远不能固化。世界上所有理论、定理、甚至真理都只是我们的‘铺路石’,不能以此来束缚自己前进的方向,如果只是在那些固定框架里去做研究,那永远也跳不出这些框框。”
在全癌标志物备受争议的大环境下,目前国内仅有上海奕谱生物基于这一方法进行肿瘤的检测,力图推动全癌标志物在肿瘤筛查中的应用。
而“别人不相信”也为奕谱生物推动全癌标志物带来便利,“今年 3 月份出台的 LDT(Laboratory developed test, 临床实验室自建项目)合法化政策对全癌标志物的验证是一个很好的机遇,这比拿到证才能开始大规模临床试验有了先天的优势,因为只有这一家在做。”
LDT 合法化:
2021 年 3 月 18 日,国家药监局网站发布修订后的《医疗器械监督管理条例》明确,“对国内尚无同品种产品上市的体外诊断试剂,符合条件的医疗机构根据本单位的临床需要,可以自行研制,在执业医师指导下在本单位内使用。”
“基于 GPS 技术发现的全癌标志物检测已与国内多家医院展开合作,并在山东菏泽开展为期 3 年的两癌筛查公益项目,计划今年完成 1 万例样本检测,目前已经完成约 6000 例。我们希望通过这次大规模检测先把菏泽地区的宫颈癌发病率降下来”,于文强表示,目前全癌标志物最多的应用是开展对宫颈癌的早期筛查,其次是膀胱癌的术后复查。
最后,他提到,在全癌标志物以及肿瘤方面,接下来他将继续探索全癌标志物在肿瘤中发生 DNA 甲基化的深层次机制,由此寻找肿瘤共同的治疗方案。
-End-
【往期】
独家专访丨港科大团队丨全脑基因编辑
Ginkgo被做空丨巨大骗局?丨被指“左手倒右手”
真化学 丨诺奖花落不对称有机催化丨革新制药 方式
mRNA丨生菜变疫苗工厂?丨食用疫苗 Nature特评丨mRNA疫苗发展史丨谁贡献最大 最新RNA编辑工具丨Cas7-11丨业内人士评价 返回搜狐,查看更多
责任编辑: